Contoh Bilangan Kuantum Magnetik
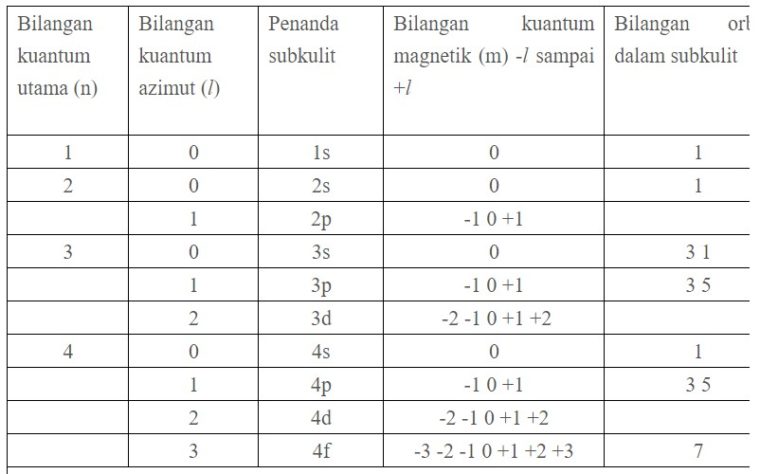
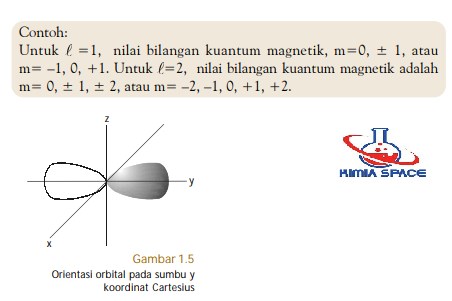
Bilangan kuantum magnetik m ini jumlahnya untuk setiap bilangan kuantum azimut l dimulai dari m l sampai ml.

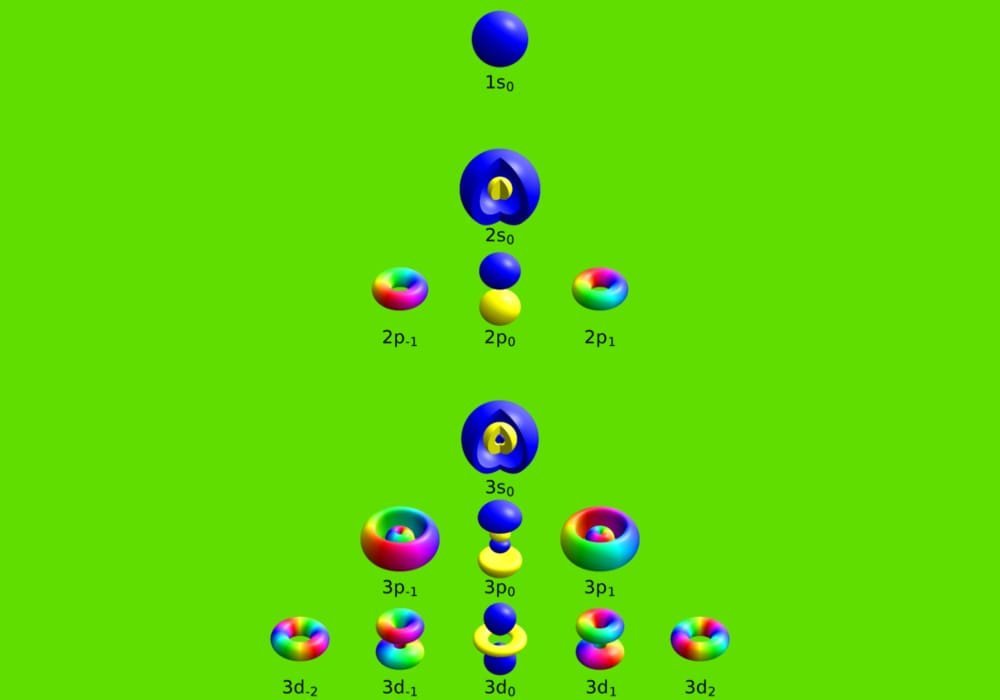
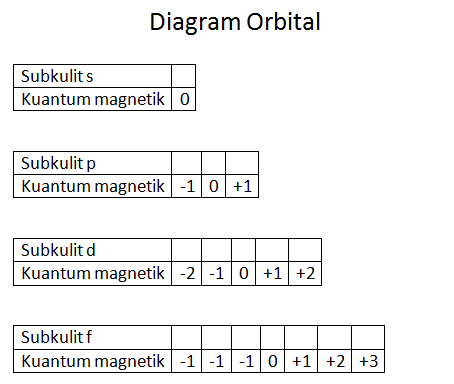
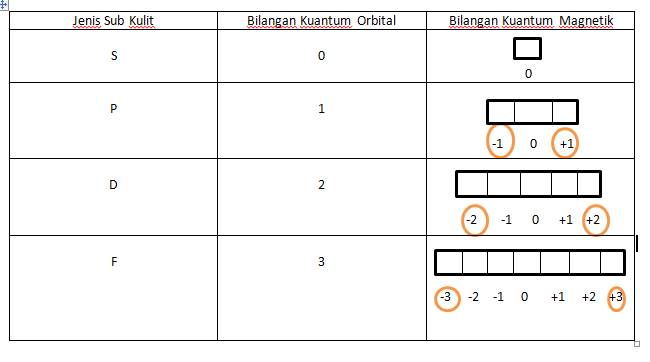
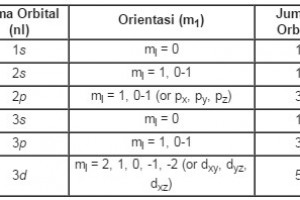
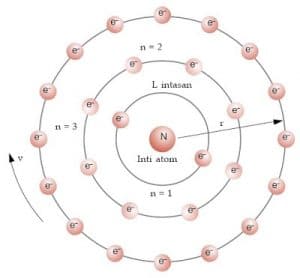
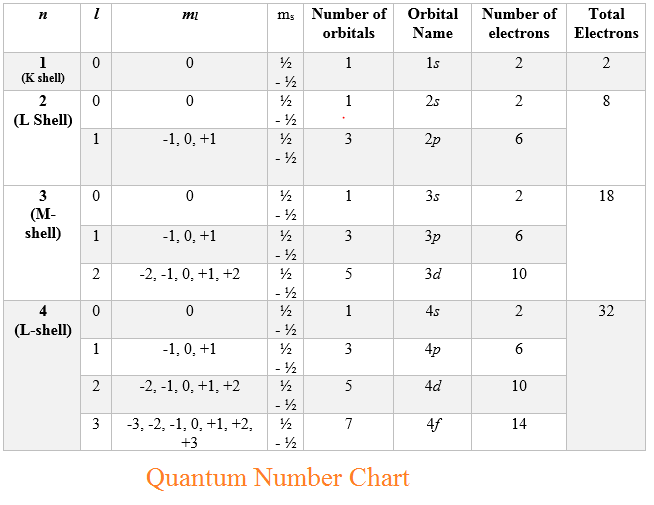
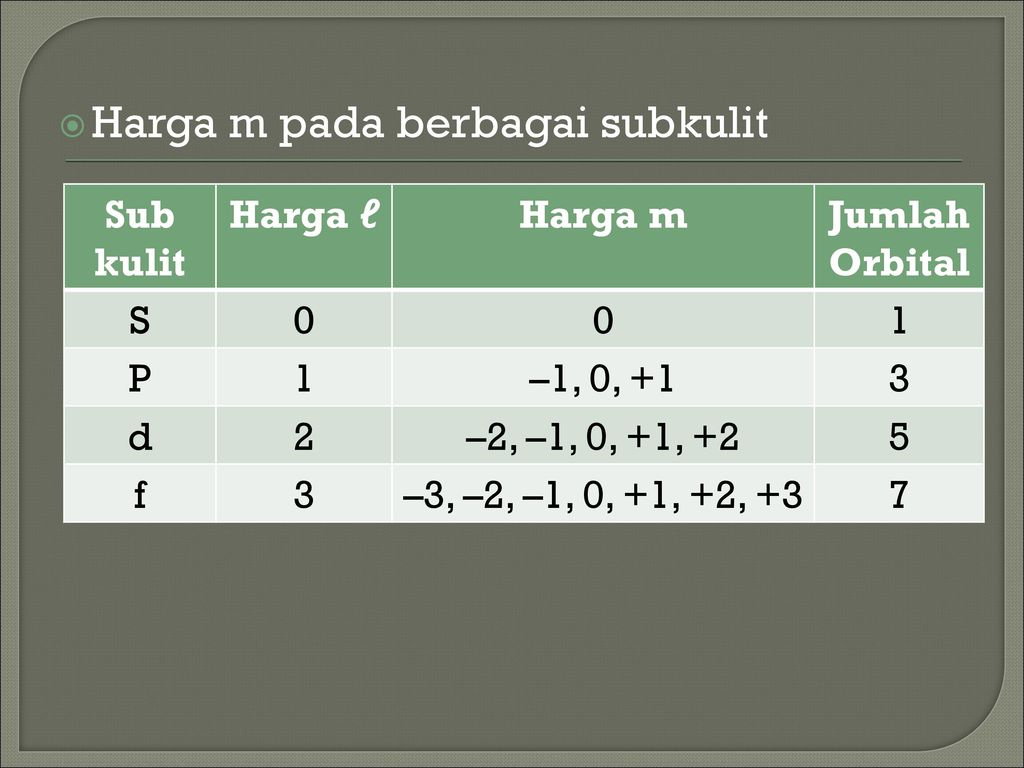
Contoh bilangan kuantum magnetik. L 0 m 0 1 orbital l 1 m 1 0 1 3 orbital l 2 m 2 2 0 1 2 5 orbital dan seterusnya. Tentukanlah bilangan kuantum utama azimut dan magnetik yang mungkin bisa jadi dimiliki oleh suatu elektron yang menempati subtingkat energi 4d. Tabel diatas menunjukan hubungan antara bilangan kuantum utama n bilangan kuantum azimuth l dan bilangan kuantum magnetik m.
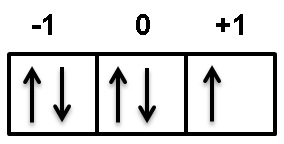
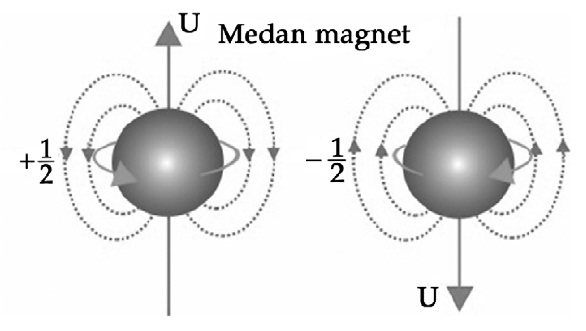
Sederhananya bilangan kuantum mampu menggambarkan lintasan dan pergerakan dari elektron yang ada pada suatu atom. Bilangan kuantum spins nilai 12 dan 12 kegunaan menyatakan arah perputaran elektron jika arah panahnya keatas 12 jika arah panahnya kebawah 12. Bilangan kuantum magnetik m bilangan kuantum spin s bilangan kuantum juga merupakan salah satu ciri khas dari model atom mekanika kuantum atau biasa disebut juga model atom modern yang dicetuskan oleh seorang ilmuwan fisika ernest schrodinger.
Jika l 2 maka m 3 2 1 0 1 23 contoh 5. Bilangan kuantum mewakili tingkat energi yang ada pada atom dan juga molekul. Orbital dan bilangan kuantum.
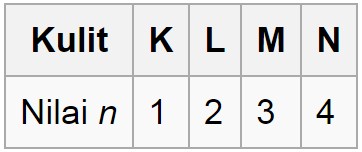
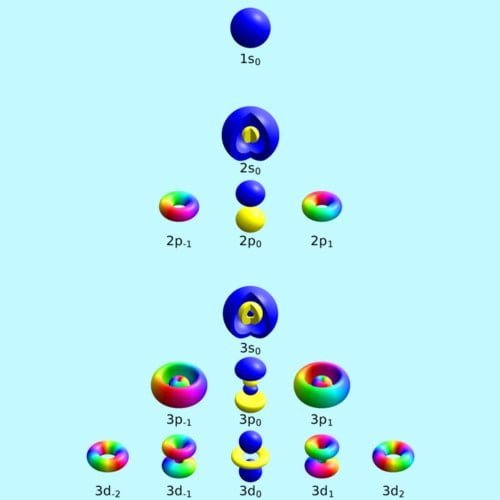
Pada fisika kuantum dikenal empat jenis bilangan kuantum yang terdiri atas kuantum utama azimut magnetik dan spin. Setiap orbital atom memiliki satu set tiga bilangan kuantum yang unik antara lain bilangan kuantum utama n azimuth atau momentum angular l dan magnetik m lketiga bilangan kuantum tersebut dapat mendeskripsikan tingkat energi orbital dan juga ukuran bentuk dan orientasi dari distribusi probabilitas radial orbital atom. Kuantum unsur 28 ni.
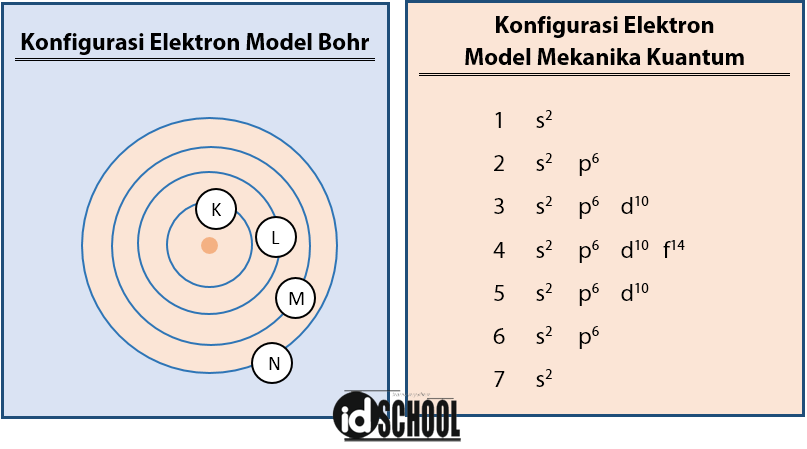
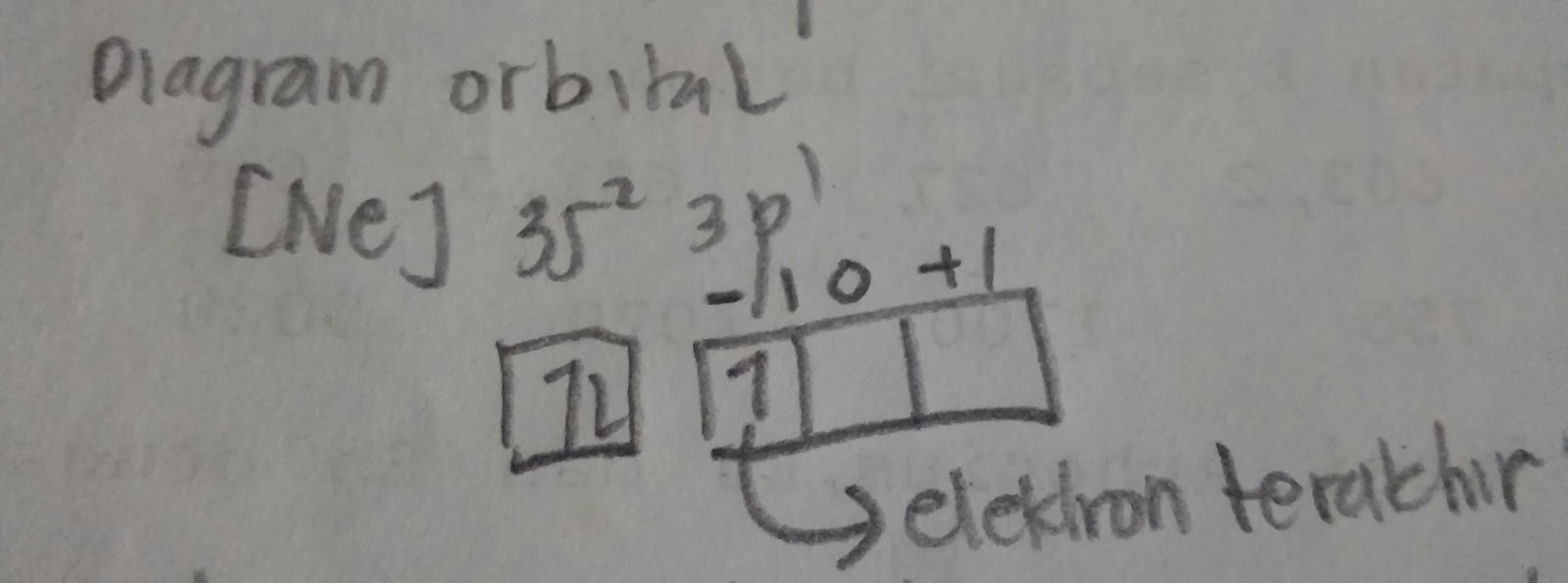
28 ni ar 4s 2 3d 8. Bilangan kuantum spin s.