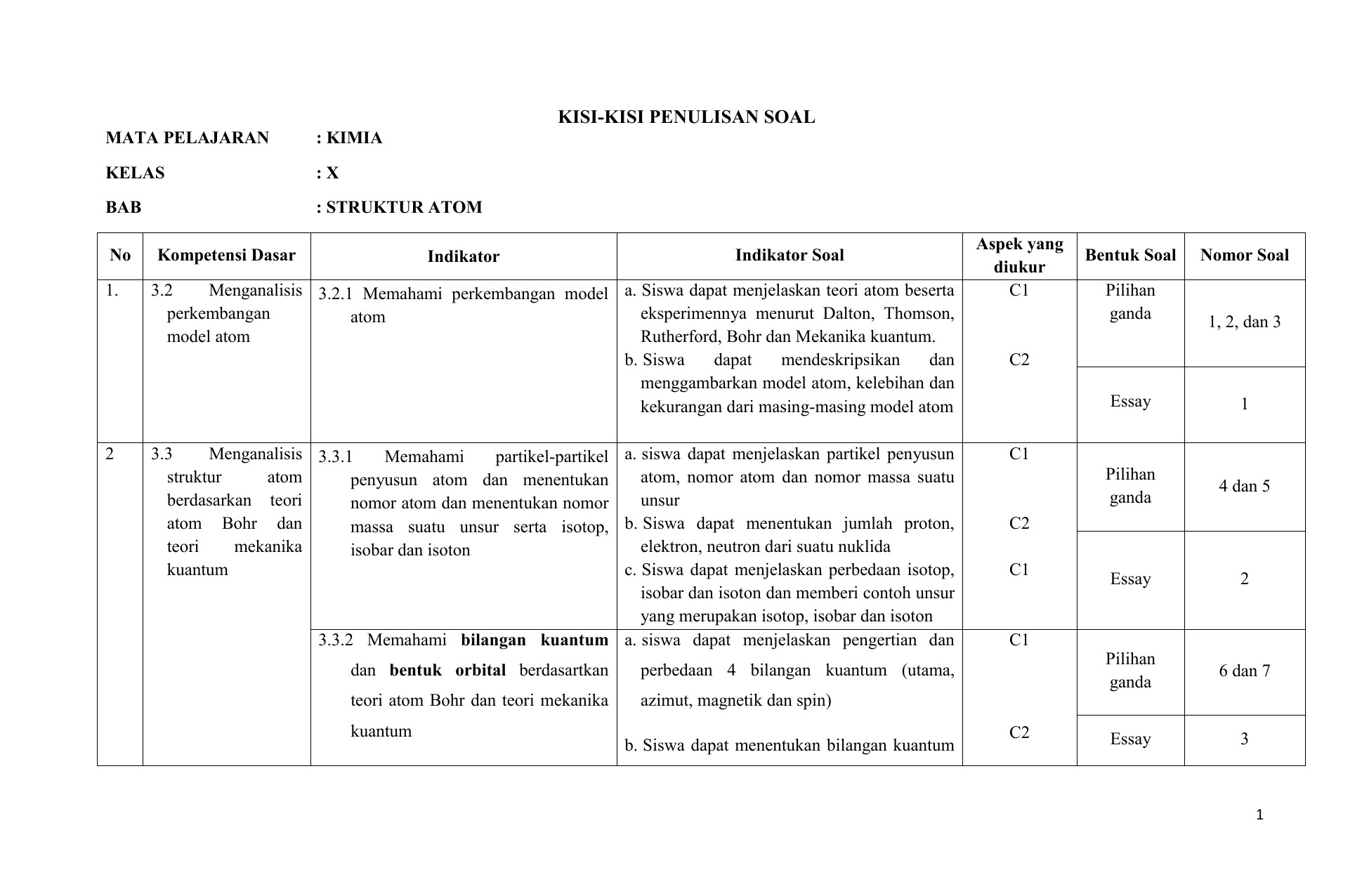
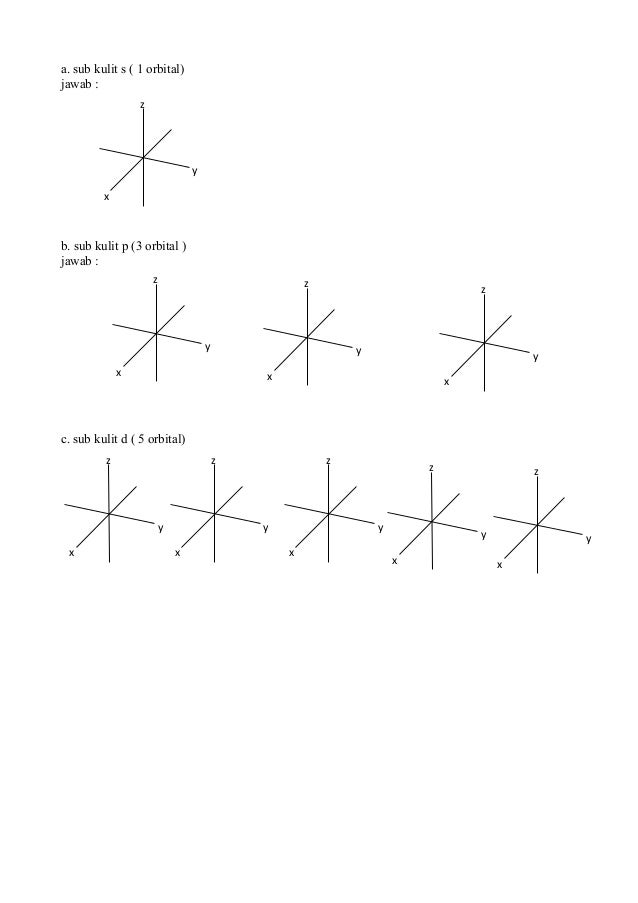
Buat Tabel Hubungan Antara Bilangan Kuantum Utama Azimut Magnetik Dan Spin
Oleh karena itu bil.

Buat tabel hubungan antara bilangan kuantum utama azimut magnetik dan spin. Tentukanlah bilangan kuantum utama azimut dan magnetik yang mungkin bisa jadi dimiliki oleh suatu elektron yang menempati subtingkat energi 4d. Setiap orbital atom memiliki satu set tiga bilangan kuantum yang unik antara lain bilangan kuantum utama n azimuth atau momentum angular l dan magnetik m lketiga bilangan kuantum tersebut dapat mendeskripsikan tingkat energi orbital dan juga ukuran bentuk dan orientasi dari distribusi probabilitas radial orbital atom. Kuantum spin hanya terdiri dari 12 dan 12.
Berikut ini akan dibahas tentang bilangan kuantum bilangan quantum 4 bilangan kuantum bilangan kuantum utama kuantum utama bilangan kuantum magnetik bilangan kuantum azimut bilangan kuantum spin bilangan spin bilangan kuantum kimia kuantum azimut kuantum magnetik bilangan kuantum magnetik menunjukkan bilangan kuantum spin menyatakan cara menentukan bilangan kuantum spin dan juga. Dibawah ini adalah contoh tabel bilangan kuantum agar kalian lebih memahami tentang bil. Berikutnya p menunjukkan sebuah bilangan kuantum azimut.
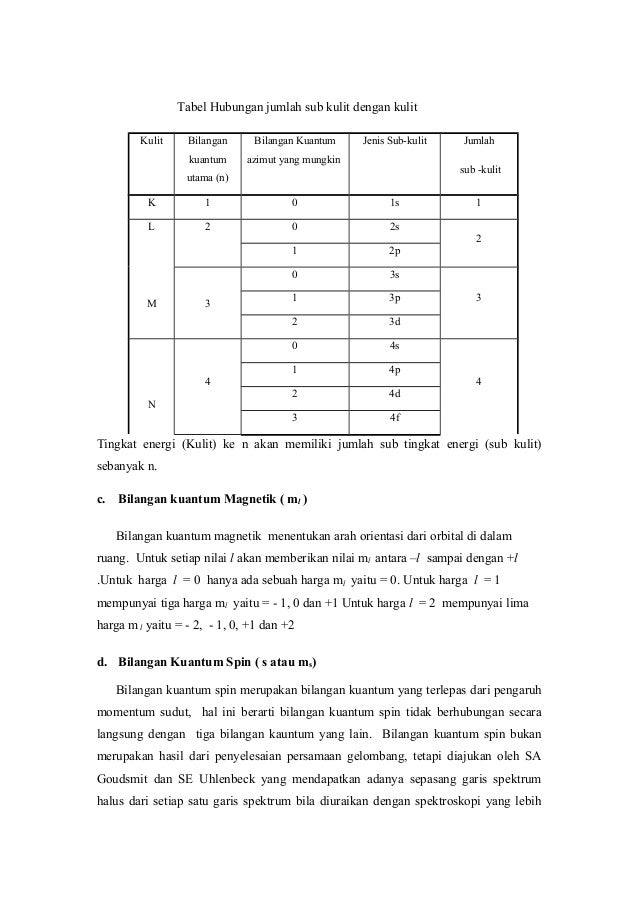
Subkulit 3d berarti harga n 3 dan l 2. Bilangan kuantum spin s. Dikarenakan berada pada subkulit p jadi l 1.
Apabila dilihat lebih teliti ternyata garis spektrum tersebut tidak hanya terdiri atas satu garis melainkan beberapa garis yang saling berdekatan. Pengertian bilangan kuantum utama azimut magnetik spin contoh soal kunci jawaban perpindahan elektron dari satu lintasan ke lintasan lain menghasilkan spektrum unsur berupa spektrum garis. Bilangan kuantum utama n azimut magnetik m dan spin s nah setelah mengetahui diagram orbital saatnya untuk mempelajari bilangan kuantum.
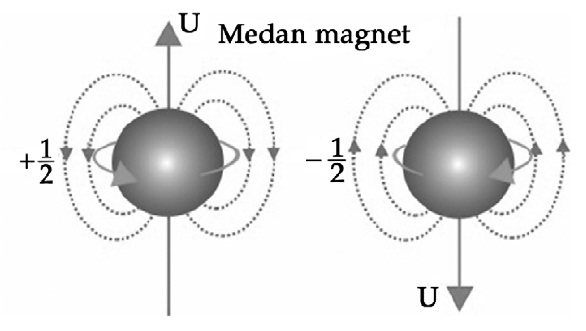
Kuantum memiliki bilangan spin 12 maka elektronnya memiliki orientasi spin up. Bilangan kuantum merupakan bilangan menyatakan kedudukan atau posisi pada elektron dalam suatu atom diwakili oleh nilai untuk menjelaskan kuantitas kekal dalam sistem yang dinamis. Tentukan nomor atom unsur jika suatu atom memiliki bilangan kuantum elektron terakhir n 2 l 1 m 1 dan s 12.
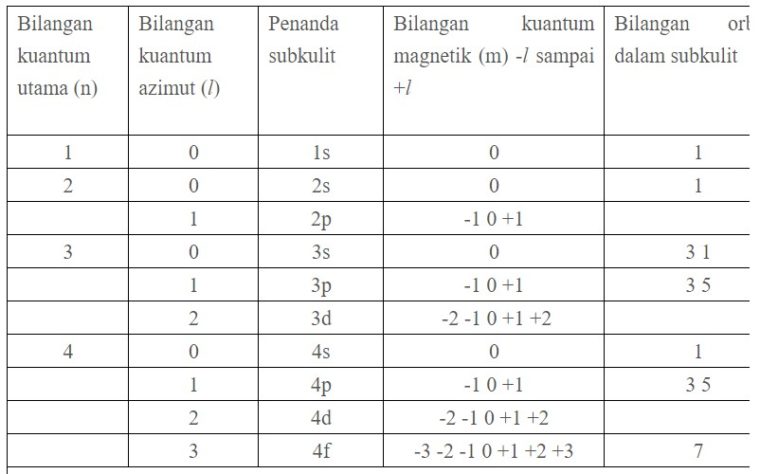
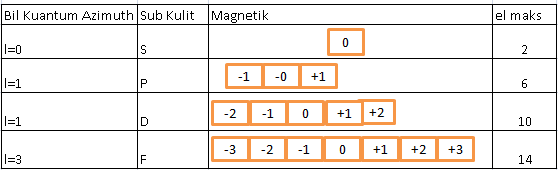
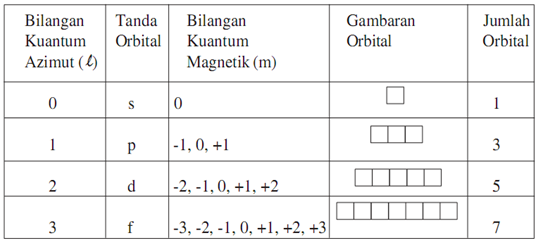
Tentukan bilangan kuantum utama azimut dan magnetik yang mungkin dimiliki oleh elektron yang menempati subtingkat energi 3d. Bilangan kuantum magnetik m ini jumlahnya untuk setiap bilangan kuantum azimut l dimulai dari m l sampai ml. Subkulit 4d berarti harga n 4 dan l 3.
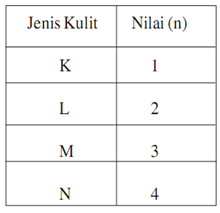
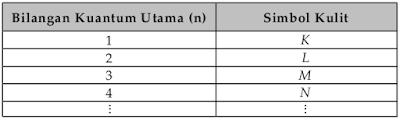
Tabel diatas menunjukan hubungan antara bilangan kuantum utama n bilangan kuantum azimuth l dan bilangan kuantum magnetik m. L0 dengan subkulit s l1 dengan subkulit p l2 dengan subkulit d dan l3 dengan subkulit f.